Cinco puntos importantes para entender la disminución del medicamento similar en México
Publicado por Ana Jimenéz en
Cinco puntos importantes para entender la disminución del medicamento similar en México
El panorama de la disponibilidad de medicamentos similares en México ha experimentado cambios significativos en los últimos años, suscitando preocupaciones y debates dentro de la industria farmacéutica y entre los consumidores.
Los medicamentos similares comparten ingredientes activos con los medicamentos de marca, pero pueden tener diferencias en términos de formulación, color, sabor y otras características no terapéuticas. Aunque se espera que los medicamentos similares sean equivalentes en cuanto a eficacia y seguridad, pueden variar ligeramente en su estructura física y presentación y no todos cuentan con las regulaciones, requisitos de bioequivalencia y/o registros que solicita la autoridad sanitaria en México.
Algunas pautas que pueden ayudarte a distinguir entre medicamento genérico y similar son: nombre, etiquetas, bioequivalencia, regulaciones COFEPRIS.
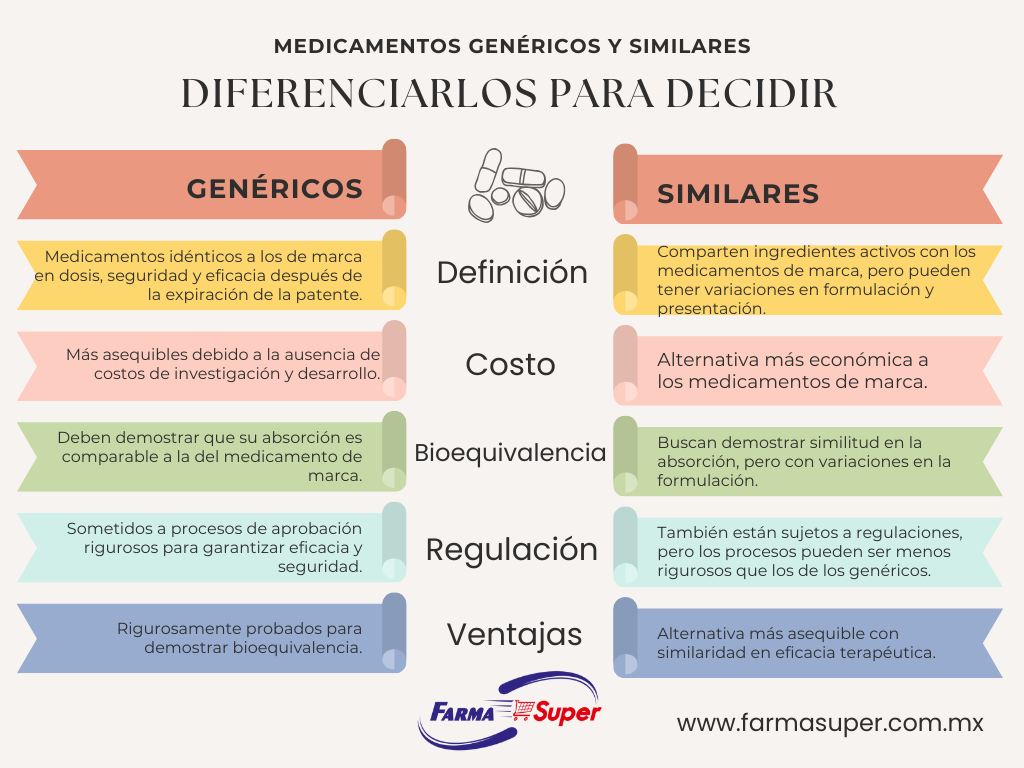
A través de cinco puntos clave, podemos obtener una comprensión más profunda de los factores que han contribuido a la disminución de la presencia de los medicamentos similares (que son diferentes a los genéricos) en el mercado mexicano.
1. Cambios en la regulación: En los últimos años, México ha implementado cambios significativos en la regulación de los medicamentos genéricos y similares. Esto incluye medidas para fortalecer los controles de calidad y seguridad de los medicamentos, lo que podría haber impactado en la disponibilidad de algunos productos.
En 2019, la COFEPRIS implementó cambios en las regulaciones para mejorar la calidad y seguridad de los medicamentos genéricos y similares en México. Estas reformas incluyeron la actualización de las normativas de buenas prácticas de fabricación (GMP) y la introducción de requisitos más estrictos para la presentación de solicitudes de registro de medicamentos.
2. Requisitos de bioequivalencia: Las autoridades regulatorias, como la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS), han establecido requisitos más estrictos en términos de bioequivalencia para los medicamentos similares (y genéricos). Esto significa que los fabricantes deben demostrar que sus productos son equivalentes en términos de absorción y efectividad terapéutica a los medicamentos de marca.
Un ejemplo concreto es el caso de la modificación de la norma NOM-177-SSA1-2013, que establece los requisitos para demostrar la bioequivalencia de los medicamentos. Los fabricantes ahora deben realizar estudios comparativos más rigurosos para demostrar que sus productos son bioequivalentes a los medicamentos de marca.
Hasta éste punto sabemos que muchos de los medicamentos similares no contaron con requisitos de bioequivalencia que los orilló a desaparecer casi por completo, exceptuando los suplementos y multivitamínicos, un nicho donde la tendencia apunta que quedarán establecidos.

3. Proceso de registro más riguroso: Los cambios en el proceso de registro de medicamentos similares pueden haber aumentado las barreras de entrada para los fabricantes. Esto podría resultar en menos opciones disponibles en el mercado, ya que solo aquellos medicamentos que cumplan con los nuevos estándares podrán ser comercializados.
Después de la implementación de las nuevas regulaciones, se observó una disminución en el número de solicitudes de registro de medicamentos similares ante la COFEPRIS. Esto sugiere que el proceso de registro se ha vuelto más selectivo y riguroso.
4. Preocupaciones sobre la calidad y seguridad: En el pasado, ha habido preocupaciones sobre la calidad y seguridad de algunos medicamentos genéricos y similares en México. Las nuevas regulaciones podrían estar destinadas a abordar estas preocupaciones y garantizar que los medicamentos disponibles en el mercado sean seguros y efectivos.
En años anteriores, se han reportado casos de medicamentos similares que no cumplen con los estándares de calidad y seguridad en México. Por ejemplo, en 2017 se retiraron del mercado varios lotes de un medicamento para la presión arterial debido a problemas de calidad.
5. Necesidad de educación y conciencia pública: En este contexto, es importante que los pacientes y profesionales de la salud estén informados sobre los cambios en la disponibilidad y regulación de medicamentos similares en México. La educación y la conciencia pública pueden ayudar a mitigar cualquier confusión o preocupación que pueda surgir como resultado de estos cambios.
Organizaciones como la Asociación Mexicana de Industrias de Investigación Farmacéutica (AMIIF) han lanzado campañas educativas para informar al público sobre los cambios en la regulación de medicamentos similares. Estas campañas buscan brindar claridad y tranquilidad a los pacientes sobre la calidad y seguridad de los medicamentos disponibles en el mercado.
El medicamento innovador de hoy es el genérico de mañana. Más del 90% del mercado de medicamentos en México es de genéricos. Y en los principales padecimientos que afectan a las y los mexicanos ese porcentaje va del 94 al 99% https://t.co/bwfL0zUW5g pic.twitter.com/BGUJ4riLRN
— AMIIF México (@AMIIFMx) June 28, 2020
También podría interesarte: “Los medicamentos genéricos más vendidos en las farmacias mexicanas en los últimos tres años”
La disminución de los medicamentos similares en México refleja cambios en el mercado farmacéutico, aunque la tendencia apunta a que no van a desaparecer sí han encontrado un nicho dónde establecerse que son los multivitamínicos y los suplementos.
Es el caso contrario para los los medicamentos genéricos de laboratorios que sí han logrado cumplir y superar las regulaciones de la autoridad sanitaria en el país y que hoy en día podemos encontrar en farmacias, son éstos los que tienen mayor cabida entres las opciones para los pacientes ya que al cumplir con toda la normatividad refuerzan la seguridad y confianza en su uso para el público y una excelente opción para ofrecer en los negocios relacionados a la salud.
Fuentes:
Diario Oficial de la Federación, SEGOB, ACUERDO POR EL QUE SE RECONOCEN COMO EQUIVALENTES LOS REQUISITOS ESTABLECIDOS EN LOS ARTÍCULOS 161 BIS, 167, 169, 170 Y 177 DEL REGLAMENTO DE INSUMOS PARA LA SALUD Y A LOS PROCEDIMIENTOS DE EVALUACIÓN TÉCNICA REALIZADOS POR LA COMISIÓN FEDERAL PARA LA PROTECCIÓN CONTRA RIESGOS SANITARIOS PARA EL OTORGAMIENTO DEL REGISTRO SANITARIO DE LOS INSUMOS PARA LA SALUD
Certificación de Buenas Prácticas de Fabricación, COFEPRIS


0 Comentarios